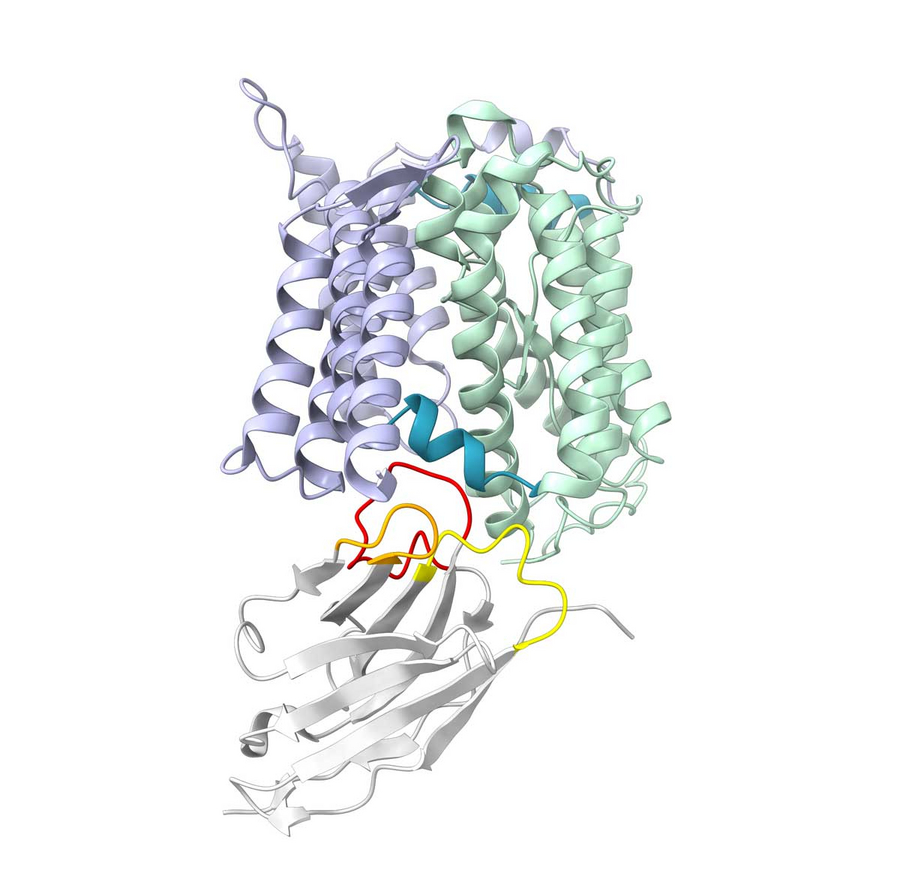
Proteinstruktur mit den Scharnierbereichen (blau), die den statischen (lila) und den beweglichen (grün) Teil eines Fahrstuhltransporters verbinden. Ein Nanobody (grau) hält das Protein in der „unteren“ Position fest. Copyright: Kuhn et al. / Nat. Commun. (2024) / MPI-CBG
Biologische Membranen umgeben alle Zellen lebender Organismen. Viele Moleküle können diese Membranen nicht ungehindert durchdringen, obwohl die Zellen sie benötigen. Um zu überleben, bedienen sich die Zellen daher einer komplexen Membrantransportmaschinerie, um beispielsweise Nährstoffe aus ihrer Umgebung aufzunehmen. Diese Maschinen sind Membrantransportproteine. Die größte Familie dieser Proteine sind die Solute Carrier (SLCs). Einige Mitglieder dieser Familie nutzen einen Transportmechanismus, der einem Fahrstuhl ähnelt: Ein beweglicher Teil des Proteins gleitet entlang eines statischen Teils des Proteins von der Außenseite der Membran ins Innere der Zelle und transportiert dabei verschiedene lebenswichtige Moleküle. Doch wie diese Bewegung koordiniert wird, war bisher unklar. Ein Forschungsteam unter der Leitung von Eric Geertsma am Max-Planck-Institut für molekulare Zellbiologie (MPI-CBG) in Dresden und zuvor an der Goethe-Universität Frankfurt, zusammen mit Mitarbeitern des Max-Planck-Instituts für Hirnforschung, des Max-Planck-Instituts für Biophysik und des Instituts für Medizinische Mikrobiologie der Universität Zürich, beschreibt nun ein bisher unbeachtetes Strukturelement in diesen Fahrstühlen, das als Scharnier zwischen dem mobilen und dem statischen Teil fungiert. Dieses Scharnier reguliert die Bewegungen des Fahrstuhls und damit seine Funktion. Dies zeigt einen weiteren wichtigen Aspekt auf, der dem Mechanismus der Proteinfamilie der Fahrstuhl-Transporter zugrunde liegt.
Fahrstuhl-Dynamik
Das Team wurde auf diesen Teil des Proteins aufmerksam, weil dieser immer übersehen worden war. “Uns ist aufgefallen, dass noch niemand die Bedeutung dieses Proteinteils untersucht hat, obwohl fast alle Fahrstuhlproteine ihn aufweisen. Das machte es für uns interessant”, erklärt Benedikt Kuhn, der Erstautor der Studie. Die Wissenschaftlerinnen und Wissenschaftler untersuchten die SLC23-Familie, deren menschliche Vertreter Vitamin C transportieren. Um zu verstehen, wie das Scharnier die Dynamik des Transporters beeinflusst, erzeugten die Forscherinnen und Forscher einzelne Aminosäurevariationen, sogenannte Mutationen. Anschließend verglichen sie das Verhalten der veränderten Proteine mit dem des ursprünglichen Proteins. Dabei verwendeten sie Sonden, die anzeigen, ob der Aufzug nach oben oder unten fährt. Sie fanden heraus, dass einzelne Mutationen in der Scharnierregion die Ruheposition des Fahrstuhls von “unten”, also mit Zugang zum Zellinneren, zu “oben”, also mit Zugang zum Zelläußeren oder zu einer Position dazwischen ändern können. Diese Mutationen wirkten sich auch erheblich auf die Transportfunktion aus.
Die Tür blockieren
Um herauszufinden, ob ein Fahrstuhl, der oben ist, noch nach unten fahren kann, verwendeten die Forscher einen Nanobody, einen kleinen Teil von Kameliden-Antikörpern, der sich speziell an den Zustand „Fahrstuhl unten“ bindet und ihn festklemmt, ähnlich wie ein Keil in einer Tür. Tatsächlich konnten die Fahrstühle, die wegen der Scharniermutation meist oben waren, durch den Nanobody im unteren Zustand gefangen werden. Dies ist insofern von Bedeutung, da die früheren Experimente nur die Position des Fahrstuhls zeigten, während dieses Experiment bestätigte, dass dieser sich immer noch nach unten bewegen kann. Der Fahrstuhl mit der anderen Mutation, der in der Mitte blieb, wurde nicht von dem Nanobody gefangen und bewegt sich daher nicht vollständig nach unten. Verschiedene Mutationen im Scharnier können also die Bewegungen des Fahrstuhls völlig verändern, was die große Bedeutung des Scharniers verdeutlicht.
Eric Geertsma, der die Studie leitete, fasst zusammen: „Unsere Ergebnisse liefern nicht nur wichtiges Grundlagenwissen darüber, wie die Transportdynamik dieser Familie von Membranproteinen organisiert ist. Sie eröffnen auch neue Wege, die bei der Reaktivierung defekter Proteine bei Krankheiten helfen könnten.“
Kuhn, B.T., Zöller, J., Zimmermann, I. et al. Interdomain-linkers control conformational transitions in the SLC23 elevator transporter UraA. Nat Commun 15, 7518 (2024). https://doi.org/10.1038/s41467-024-51814-8